viernes, 24 de mayo de 2013
Por qué existe una tabla
jueves, 16 de mayo de 2013
Visión histórica del átomo
 Los
filósofos griegos discutieron mucho sobre la naturaleza de la materia y
concluyeron que el mundo era más sencillo de lo que parecía.
Los
filósofos griegos discutieron mucho sobre la naturaleza de la materia y
concluyeron que el mundo era más sencillo de lo que parecía.
En el siglo V a.c., Leucipo pensaba que sólo
había un tipo de materia. Sostenía, además, que si dividíamos la materia en
partes cada vez más pequeñas, acabaríamos encontrando una porción que no se
podría seguir dividiendo. Un discípulo suyo, Demócrito, bautizó a estas partes
indivisibles de materia con el nombre de átomos, término que en griego significa
“que no se puede dividir”.
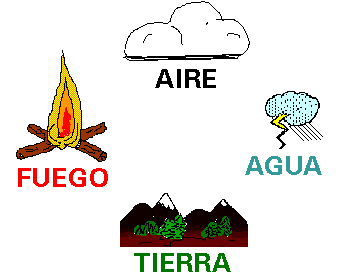
Empédocles estableció que la materia estaba
formada por 4 elementos: tierra, agua, aire y fuego.
Aristóteles
negó la existencia de los átomos de Demócrito y reconoció la teoría de los 4
elementos, que, gracias al prestigio que tenía, se mantuvo vigente en el
pensamiento de la humanidad durante 2000 años. Hoy sabemos que aquellos 4
elementos iniciales no forman parte de los 106 elementos químicos actuales.
Malena Passero
martes, 14 de mayo de 2013
Modelo atómico de Rutherford
El modelo atómico de Rutherford es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandéz. Ernest Rutherford para explicar los resultados de su experimento de la lámina de oro, realizado en 1911.
Este experimento consistió en :
 _Colocar un electrodo que expulsara partículas alfa
_Colocar un electrodo que expulsara partículas alfa
_Enfrente de ese electrodo colocar una fina lámina de oro
_Detrás de la lamina de oro un recipiente floreciente
Al cruzar por la lámina de oro, las partículas alfa cruzaban cerca del núcleo de las moléculas de oro y se desviaban chocando con la lámina fluorescente dando un destello.
Nahuel Sack, Alexis criscuoli
El modelo atómico de Rutherford es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandéz. Ernest Rutherford para explicar los resultados de su experimento de la lámina de oro, realizado en 1911.
Este experimento consistió en :
_Enfrente de ese electrodo colocar una fina lámina de oro
_Detrás de la lamina de oro un recipiente floreciente
Al cruzar por la lámina de oro, las partículas alfa cruzaban cerca del núcleo de las moléculas de oro y se desviaban chocando con la lámina fluorescente dando un destello.
Nahuel Sack, Alexis criscuoli
viernes, 10 de mayo de 2013
John Dalton y su modelo atómico
La era atómica comenzó en 1808, cuando un profesor de escuela presentó sus ideas respecto a cómo debían ser las partículas más pequeñas de materia.
 Nació en Eaglesfield, Inglaterra, en 1766, en el seno de una humilde familia de tejedores. Siendo todavía un niño, tenía que ayudar a sus padres a tejer ropa y trabajar en las labores del campo, al mismo tiempo que estudiaba. Su familia pertenecía a un grupo religioso cuyos acólitos se llaman “cuáqueros”, que en síntesis, promueven la humildad y reniegan de las autoridades eclesiásticas.
Nació en Eaglesfield, Inglaterra, en 1766, en el seno de una humilde familia de tejedores. Siendo todavía un niño, tenía que ayudar a sus padres a tejer ropa y trabajar en las labores del campo, al mismo tiempo que estudiaba. Su familia pertenecía a un grupo religioso cuyos acólitos se llaman “cuáqueros”, que en síntesis, promueven la humildad y reniegan de las autoridades eclesiásticas. A diferencia de otros niños pobres, él pudo ir a la escuela y tuvo un buen profesor que lo incentivó a seguir estudiando. Se esforzó, tuvo buenas notas y con sólo 12 años, empezó a trabajar como profesor, debido a sus necesidades económicas. Le encantaba investigar y aprender, y con ese espíritu trabajó durante toda su vida. Cuando murió, a los 78 años (1844), miles de personas acudieron a rendirle homenaje en el funeral. ¿Sabes de quién estamos hablando? De John Dalton, el responsable del primer modelo de átomo con base científica. En el fondo, con Dalton la humanidad comenzó el camino que la condujo a utilizar la energía atómica.
El modelo atómico de Dalton fue expuesto en un libro llamado “Nuevo sistema de filosofía química”, y en síntesis decía lo siguiente:
- La materia está formada por partículas pequeñísimas llamadas “átomos”.
- Estos átomos no se pueden dividir ni romper, no se crean ni se destruyen en ninguna reacción química, y nunca cambian.
- Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa y dimensiones; por ejemplo, todos los átomos de hidrógeno son iguales.
- Por otro lado, los átomos de elementos diferentes, son diferentes; por ejemplo, los átomos de oxígeno son diferentes a los átomos de hidrógeno.
- Los átomos pueden combinarse para formar compuestos químicos. Por ejemplo, los átomos de hidrógeno y oxígeno pueden combinarse y formar moléculas de agua.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto. Por ejemplo, un átomo de carbono con uno de oxígeno forman monóxido de carbono (CO), mientras que dos átomos de oxígeno con uno de carbono, forman dióxido de carbono (CO2)
Esa no fue, sin embargo, la única contribución de John Dalton. Hizo muchos otros aportes en el campo de la meteorología y la física, e incluso en la medicina: cuando tenía 26 años se dio cuenta de que tanto él como su hermano confundían los colores. Realizó un detallado estudio de la enfermedad visual que padecía, el primero de su tipo, y por tanto desde ese momento se llamó “daltonismo”. En 1832 fue invitado a visitar al rey Guillermo IV y, cuál no fue la sorpresa de los presentes cuando el eminente científico llegó vistiendo un llamativo traje de color rojo. Claro, él lo veía gris oscuro, porque era, además de Dalton, daltónico.
Joaquin Lucas Torterolo
martes, 7 de mayo de 2013
Modelo Atómico de Bohr
|
domingo, 5 de mayo de 2013
Biografia de Dalton, Thompson y Rutherford
John Dalton
 Manchester, Reino Unido, 18 de diciembre de 1856 y murió en Cambridge, Reino Unido, 30 de agosto de 1940; fue un científico británico, descubridor del electrón, de los isótopos e inventor del espectrómetro de masa. En 1906 fue galardonado con el Premio Nobel de Física.
Manchester, Reino Unido, 18 de diciembre de 1856 y murió en Cambridge, Reino Unido, 30 de agosto de 1940; fue un científico británico, descubridor del electrón, de los isótopos e inventor del espectrómetro de masa. En 1906 fue galardonado con el Premio Nobel de Física.
Descubrimiento de los isótopos:
 Conocido también como Lord Rutherford: Brightwater, Nueva Zelanda, 30 de agosto de 1871 y murió en Cambridge, Reino Unido, 19 de octubre de 1937; fue un físico y químico neozelandés.
Conocido también como Lord Rutherford: Brightwater, Nueva Zelanda, 30 de agosto de 1871 y murió en Cambridge, Reino Unido, 19 de octubre de 1937; fue un físico y químico neozelandés.
 En 1907, obtiene una plaza de profesor en la Universidad de Mánchester, en donde trabajará junto a Hans Geiger. Junto a éste, inventará un contador que permite detectar las partículas alfa emitidas por sustancias radiactivas (prototipo del futuro contador Geiger), ya que ionizando el gas que se encuentra en el aparato, producen una descarga que se puede detectar. Este dispositivo les permite estimar el número de Avogadro de modo muy directo: averiguando el periodo de desintegración del radio, y midiendo con su aparato el número de desintegraciones por unidad de tiempo. De ese modo dedujeron el número de átomos de radio presente en su muestra.
En 1907, obtiene una plaza de profesor en la Universidad de Mánchester, en donde trabajará junto a Hans Geiger. Junto a éste, inventará un contador que permite detectar las partículas alfa emitidas por sustancias radiactivas (prototipo del futuro contador Geiger), ya que ionizando el gas que se encuentra en el aparato, producen una descarga que se puede detectar. Este dispositivo les permite estimar el número de Avogadro de modo muy directo: averiguando el periodo de desintegración del radio, y midiendo con su aparato el número de desintegraciones por unidad de tiempo. De ese modo dedujeron el número de átomos de radio presente en su muestra.
Eaglesfield, Cumberland (Reino Unido), 6 de septiembre de 1766 y murió Mánchester, 27 de julio de 1844; fue un naturalista, químico, matemático y meteorólogobritánico.
John Dalton nació en una familia cuáquera de la población de Eaglesfield, en Cumberland, Inglaterra. Hijo de un tejedor, sabemos que tuvo cinco hermanos, de los cuales sobrevivieron dos: Jonathan, mayor que Dalton, y Mary, de la que se desconoce su fecha de nacimiento. Dalton fue enviado a una escuela cuáquera donde aprendió matemática y destacó lo suficiente para, a la edad de 12 años, poder contribuir a la economía familiar dando clases a otros niños, primero en su casa y después en el templo cuáquero. Los ingresos eran modestos por lo que se dedicó a trabajos agrícolas hasta que en 1781 se asoció con su hermano Jonathan, que ayudaba a uno de sus primos a llevar una escuela cuáquera en la cercana Kendal.
Teoría Atómica:
La más importante de todas las investigaciones de Dalton fue la teoría atómica, que está indisolublemente asociada a su nombre. Se ha propuesto que esta teoría se la sugirieron, o bien sus investigaciones sobre el etileno («gas oleificante») y metano (hidrógeno carburado) o los análisis que realizó del óxido nitroso (protóxido de nitrógeno) y del dióxido de nitrógeno (dióxido de ázoe), son puntos de vista que descansan en la autoridad de Thomas Thomson. Sin embargo, un estudio de los cuadernos de laboratorio propio de Dalton, descubierto en las habitaciones de la Lit & Phil, llegó a la conclusión de que lejos de haber sido llevado por su búsqueda de una explicación de la ley de las proporciones múltiples a la idea de que la combinación química consiste en la interacción de los átomos de peso definido y característico, la idea de los átomos surgió en su mente como un concepto puramente físico, inducido por el estudio de las propiedades físicas de la atmósfera y otros gases. Los primeros indicios de esta idea se encuentran al final de su nota ya mencionada sobre la absorción de gases, que fue leída el 21 de octubre de 1803, aunque no se publicó hasta 1805.
Joseph John Thompson
 Manchester, Reino Unido, 18 de diciembre de 1856 y murió en Cambridge, Reino Unido, 30 de agosto de 1940; fue un científico británico, descubridor del electrón, de los isótopos e inventor del espectrómetro de masa. En 1906 fue galardonado con el Premio Nobel de Física.
Manchester, Reino Unido, 18 de diciembre de 1856 y murió en Cambridge, Reino Unido, 30 de agosto de 1940; fue un científico británico, descubridor del electrón, de los isótopos e inventor del espectrómetro de masa. En 1906 fue galardonado con el Premio Nobel de Física.
Thomson nació en 1856 en Cheetham Hill, un distrito de Manchester en Inglaterra, y tenía ascendencia escocesa. En 1870 estudió ingeniería en el Owens College, hoy parte de la Universidad de Manchester, y se trasladó al Trinity College de Cambridge en 1876. En 1880, obtuvo su licenciatura en Matemáticas (Segunda Wrangler y segundo premio Smith) y MA (obteniendo el Premio Adams) en 1883. En 1884 se convirtió en profesor de Física en Cavendish. Uno de sus alumnos fue Ernest Rutherford, quien más tarde sería su sucesor en el puesto.
En 1890 se casó con Rose Elizabeth Paget, hija de Sir Edward George Paget, KCB, un médico, y en ese entonces Regius Profesor de Medicina (Regius Professor of Physic) en Cambridge. Con ella, fue padre de un hijo, George Paget Thomson, y una hija, Joan Paget Thomson. Su hijo se convirtió en un destacado físico, quien a su vez fue galardonado con el Premio Nobel de Física en 1937 por demostrar las propiedades de tipo ondulatorio de los electrones.
También, Thomson examinó los rayos positivos y, en 1911, descubrió la manera de utilizarlos para separar átomos de diferente masa. El objetivo se consiguió desviando los rayos positivos en campos eléctricos y magnéticos (espectrometría de masas). Así descubrió que el neón tiene dos isótopos (el neón-20 y el neón-22).
En la esquina inferior derecha de esta placa fotográfica hay marcas para los dos isótopos del neón: neón - 20 y neón - 22. En 1913, como parte de su exploración en la composición de los rayos canales, Thomson canalizó una corriente de neón ionizado mediante un campo magnético y un campo eléctrico y midió su desviación colocando una placa fotográfica en el camino del rayo. Thomson observó dos parches de luz sobre la placa fotográfica (ver imagen a la derecha), lo que supone dos parábolas de desviación. Thomson llegó a la conclusión de que el gas neón se compone de dos tipos de átomos de diferentes masas atómicas (neón-20 y neón-22).
Ernest Rutherford
 Conocido también como Lord Rutherford: Brightwater, Nueva Zelanda, 30 de agosto de 1871 y murió en Cambridge, Reino Unido, 19 de octubre de 1937; fue un físico y químico neozelandés.
Conocido también como Lord Rutherford: Brightwater, Nueva Zelanda, 30 de agosto de 1871 y murió en Cambridge, Reino Unido, 19 de octubre de 1937; fue un físico y químico neozelandés.
Se dedicó al estudio de las partículas radioactivas y logró clasificarlas en alfa (α), beta (β) y gamma (γ). Halló que la radiactividad iba acompañada por una desintegración de loselementos, lo que le valió ganar el Premio Nobel de Química en 1908. Se le debe un modelo atómico, con el que probó la existencia del núcleo atómico, en el que se reúne toda la cargapositiva y casi toda la masa del átomo. Consiguió la primera transmutación artificial con la colaboración de su discípulo Frederick Soddy.
Su padre, James, era un escocés granjero y mecánico, y su madre, Martha Rutherford, nacida en Inglaterra, que era maestra, emigró antes de casarse. Ambos deseaban dar a sus hijos una buena educación y tratar de que pudiesen proseguir sus estudios.
Rutherford destacó muy pronto por su curiosidad y su capacidad para la aritmética. Sus padres y su maestro lo animaron mucho, y resultó ser un alumno brillante, lo que le permitió entrar en el Nelson College, en el que estuvo tres años. También tenía grandes cualidades para el rugby, lo que le valía ser muy popular en su escuela. El último año, terminó en primer lugar en todas las asignaturas, gracias a lo cual entró en la Universidad, en el Canterbury College, en el que siguió practicando el rugby y en el que participó en los clubes científicos y de reflexión.
El núcleo atómico:
 En 1907, obtiene una plaza de profesor en la Universidad de Mánchester, en donde trabajará junto a Hans Geiger. Junto a éste, inventará un contador que permite detectar las partículas alfa emitidas por sustancias radiactivas (prototipo del futuro contador Geiger), ya que ionizando el gas que se encuentra en el aparato, producen una descarga que se puede detectar. Este dispositivo les permite estimar el número de Avogadro de modo muy directo: averiguando el periodo de desintegración del radio, y midiendo con su aparato el número de desintegraciones por unidad de tiempo. De ese modo dedujeron el número de átomos de radio presente en su muestra.
En 1907, obtiene una plaza de profesor en la Universidad de Mánchester, en donde trabajará junto a Hans Geiger. Junto a éste, inventará un contador que permite detectar las partículas alfa emitidas por sustancias radiactivas (prototipo del futuro contador Geiger), ya que ionizando el gas que se encuentra en el aparato, producen una descarga que se puede detectar. Este dispositivo les permite estimar el número de Avogadro de modo muy directo: averiguando el periodo de desintegración del radio, y midiendo con su aparato el número de desintegraciones por unidad de tiempo. De ese modo dedujeron el número de átomos de radio presente en su muestra.
En 1908, junto a uno de sus estudiantes, Thomas Royds, demuestra de modo definitivo lo que se suponía: que las partículas alfa son núcleos de helio. En realidad, lo que prueban es que una vez liberadas de su carga, las partículas alfa son átomos de helio. Para demostrarlo, aisló la sustancia radiactiva en un material suficientemente delgado para que las partículas alfa lo atravesaran efectivamente, pero para ello bloquea cualquier tipo de "emanación" de elementos radiactivos, es decir, cualquier producto de la desintegración. Recoge a continuación el gas que se halla alrededor de la caja que contiene las muestras, y analiza su espectro. Encuentra entonces gran cantidad de helio: los núcleos que constituyen las partículas alfa han recuperado electrones disponibles.
Ese mismo año gana el Premio Nobel de Química por sus trabajos de 1908. Sufrirá sin embargo un pequeño disgusto, pues él se considera fundamentalmente un físico. Una de sus citas más famosas es que "la ciencia, o es Física, o es filatelia", con lo que sin duda situaba la física por encima de todas las demás ciencias.
Brandon S. Sosa Peralta.
Modelo mecánico del átomo de Bohr
A continuación se presenta un montaje experimental que permite demostrar la aparición de ondas estacionarias circulares en un anillo de caucho que se hace vibrar. Considerando que el anillo representa la órbita seguida por el electrón alrededor del protón, y que el electrón puede visualizarse como una onda de materia, se encuentra que solo para ciertas frecuencias de vibración del sistema aparecen estados estacionarios. Estos corresponden, según la analogía establecida, a las órbitas estables planteadas por Bohr en su modelo.Materiales & Equipos
- Generador de señales
- Parlante
- Tabla de madera con anillo de cauchos
Descripción del experimento
El modelo del átomo de hidrógeno planteado por Niels Bohr en 1.913 consiste en un núcleo conformado por un protón sobre el que gira un electrón siguiendo una órbita circular. El electrón no se precipita hacia el núcleo por acción de la fuerza electrostática existente entre las cargas debido a que hay ciertas órbitas estables en las que puede permanecer el electrón.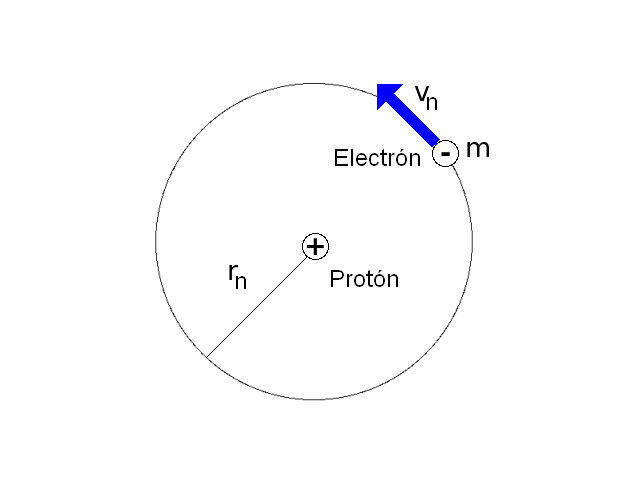
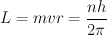
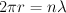
V.A
Biografia de Bohr
Niels Henrik David Bohr
Copenhague, Dinamarca
Fallecimiento:
18 de noviembre de
1962, 77 años ibíd.
Residencia:
Dinamarca
Nacionalidad: Danesa
Campo:
Física
Instituciones:
Universidad de Copenhague
Alma
máter: Universidad de
Copenhague
Supervisor
doctora: Christian
Christiansen
Conocido
por :Realizar
importantes contribuciones para la comprensión de la estructura del átomo.
Premios
Destacados: Premio
Nobel de Física en 1922
| V.A | |
|---|---|
viernes, 3 de mayo de 2013
Teorías
Atomistas de Dalton, Thomson y Rutherford
 joshep John Thomson: realizó una serie de
experimentos en tubos de rayos catódicos, que le condujeron al descubrimiento
de los electrones. Thomson utilizó el tubo de rayos catódicos en tres
diferentes experimentos.
joshep John Thomson: realizó una serie de
experimentos en tubos de rayos catódicos, que le condujeron al descubrimiento
de los electrones. Thomson utilizó el tubo de rayos catódicos en tres
diferentes experimentos.
En su tercer experimento (1897), Thomson determinó la
relación entre la carga y la masa de los rayos catódicos, al medir cuánto se
desvían por un campo magnético y la cantidad de energía que llevan. Encontró
que la relación carga/masa era más de un millar de veces superior a la del ion
Hidrógeno, lo que sugiere que las partículas son muy livianas o muy cargadas
Las conclusiones de Thomson fueron audaces: los rayos catódicos estaban hechos de partículas que llamó "corpúsculos", y estos corpúsculos procedían de dentro de los átomos de los electrodos, lo que significa que los átomos son, de hecho, divisibles. Thomson imaginó que el átomo se compone de estos corpúsculos en un mar lleno de carga positiva; a este modelo del átomo, atribuido a Thomson, se le llamó el modelo de pudín de pasas.
Las conclusiones de Thomson fueron audaces: los rayos catódicos estaban hechos de partículas que llamó "corpúsculos", y estos corpúsculos procedían de dentro de los átomos de los electrodos, lo que significa que los átomos son, de hecho, divisibles. Thomson imaginó que el átomo se compone de estos corpúsculos en un mar lleno de carga positiva; a este modelo del átomo, atribuido a Thomson, se le llamó el modelo de pudín de pasas.
 El modelo atómico de Thomson, es una
teoría sobre la estructura atómica propuesta en 1904 por Joseph John Thomson,
descubridor del electrón en 1897, mucho antes del descubrimiento del protón y
del neutrón. En dicho modelo, el átomo está compuesto por electrones de carga
negativa en un átomo positivo, como un budín de pasas. Se pensaba que los
electrones se distribuían Dicho modelo fue rebatido tras el experimento de
Rutherford, cuando se descubrió el núcleo del átomo. uniformemente alrededor
del átomo. En otras ocasiones, en lugar de una sopa de carga negativa se
postulaba con una nube de carga positiva.
El modelo atómico de Thomson, es una
teoría sobre la estructura atómica propuesta en 1904 por Joseph John Thomson,
descubridor del electrón en 1897, mucho antes del descubrimiento del protón y
del neutrón. En dicho modelo, el átomo está compuesto por electrones de carga
negativa en un átomo positivo, como un budín de pasas. Se pensaba que los
electrones se distribuían Dicho modelo fue rebatido tras el experimento de
Rutherford, cuando se descubrió el núcleo del átomo. uniformemente alrededor
del átomo. En otras ocasiones, en lugar de una sopa de carga negativa se
postulaba con una nube de carga positiva.
Limitaciones del modelo atómico de Thomson:
Según el modelo de Thomson, los átomos están constituidos
por una distribución de carga y masa regular, y éstos están unidos unos con
otros formando la sustancia. Es decir, la sustancia debería poseer una
estructura interna homogénea y, por tanto, las partículas al atravesarla
deberían tener un comportamiento uniforme. Tras los experimentos de Rutherford,
y tras el descubrimiento de las partículas subatómicas se vio que lo dicho por
Thomson no se cumplía.
Por otro lado,
aunque Thomson explicó la formación de iones, dejó sin explicación la
existencia de las otras reacciones.
 John Dalton: tomó como punto de partida una serie de
evidencias experimentales conocidas en su época:
John Dalton: tomó como punto de partida una serie de
evidencias experimentales conocidas en su época:
ü Las sustancias elementales
no pueden descomponerse.
ü Las
sustancias, simples o compuestas, tienen siempre las mismas propiedades
características.
ü Los elementos no
desaparecen al formarse un compuesto, pues se pueden recuperar por
descomposición de éste.
ü La masa se
conserva en las reacciones químicas, que provenía de la Ley de
conservación de la masa del químico francés Lavoisier.
ü La
proporción de los elementos que forman un compuesto es constante, que provenía
de la Ley de las proporciones definidas del también químico
francés Proust.
La materia está formada por partículas
pequeñísimas llamadas “átomos”. Estos átomos no se pueden dividir ni romper, no
se crean ni se destruyen en ninguna reacción química, y nunca cambian. Los
átomos de un mismo elemento son iguales entre sí, tienen la misma masa y
dimensiones; por ejemplo, todos los átomos de hidrógeno son iguales. Por otro
lado, los átomos de elementos diferentes, son diferentes; por ejemplo, los
átomos de oxígeno son diferentes a los átomos de hidrógeno. Los átomos pueden
combinarse para formar compuestos químicos. Por ejemplo, los átomos de
hidrógeno y oxígeno pueden combinarse y formar moléculas de agua. Los átomos,
al combinarse para formar compuestos guardan relaciones simples. Los átomos de
elementos diferentes se pueden combinar en proporciones distintas y formar más
de un compuesto. Por ejemplo, un átomo de carbono con uno de oxígeno forman
monóxido de carbono, mientras que dos átomos de oxígeno con uno de carbono,
forman dióxido de carbono.
El modelo
atómico de Dalton, fue el primer modelo atómico con bases
científicas, formulado en 1808 . Para Dalton los átomos
eran esferas macizas.
Dalton
explicó su teoría formulando una serie de enunciados simples:
.La
materia está formada por partículas muy pequeñas llamadas, que son indivisibles
y no se pueden destruir.
·Los átomos de un mismo elemento son iguales
entre sí, tienen su propio peso y cualidades propias. Los átomos de
los diferentes elementos tienen pesos diferentes.
·Los átomos
permanecen sin división, aún cuando se combinen en las reacciones químicas.
·Los átomos, al combinarse para
formar compuestos guardan relaciones simples.
· Los
átomos de elementos diferentes se pueden combinar en proporciones distintas y
formar más de un compuesto. Los compuestos químicos se forman al unirse
átomos de dos o más elementos distintos.
Limitaciones del modelo atómico de Dalton:
En un principio, Dalton dijo que la materia estaba formada
por átomos, es decir, por partículas indivisibles e inalterables. Pero al
descubrirse la existencia de las partículas subátomicas, se comprobó que el
átomo no era indivisible. A pesar de que la teoría de Dalton era errónea,
significó un avance muy importante en el camino de la comprensión de la
materia. Además, la aceptación del modelo de Dalton no fue inmediata, y durante
bastantes años muchos científicos se resistieron a reconocer la existencia del
átomo.

Ernest
Rutherford centró sus investigaciones en las
características de las radiactividad, diseñando su famosa experiencia de
bombardear láminas delgadas de distintas sustancias, utilizando como
proyectiles las partículas alfa (α).
Realizó en
1911 una experiencia que supuso en paso adelante muy importante en el
conocimiento del átomo. La experiencia de Rutherford consistió en bombardear
con partículas alfa una finísima lámina de oro. Las partículas alfa atravesaban
la lámina de oro y eran recogidas sobre una pantalla de sulfuro de cinc. Poseía
información sobre el tamaño, masa y carga del núcleo, pero no tenía información
alguna acerca de la distribución o posición de los electrones.
El modelo
atómico de Rutherford es unateoría sobre la estructura interna
del átomo propuesto por el químico y físico británico neozelandés Ernest
Rutherford para explicar los resultados de su "experimento de la
lámina de oro", realizado en 1911.
El modelo
de Rutherford fue el primer modelo atómico que consideró al átomo formado por
dos partes: la "corteza", constituida por todos sus electrones,
girando a gran velocidad alrededor de un "núcleo", muy pequeño, que
concentra toda la carga eléctrica positiva y casi toda la masa del átomo. 

Limitaciones del modelo atómico de Rutherford:
Rutherford propuso que los electrones orbitarían en ese
espacio vacío alrededor de un minúsculo núcleo atómico, situado en el centro
del átomo. Además se abrían varios problemas nuevos que llevarían al
descubrimiento de nuevos hechos y teorías al tratar de explicarlos:
Por un lado se planteó el problema de cómo un conjunto de
cargas positivas podían mantenerse unidas en un volumen tan pequeño, hecho que
llevó posteriormente a la postulación y descubrimiento de la fuerza nuclear
fuerte, que es una de las cuatro interacciones fundamentales.
Por otro lado existía otra dificultad proveniente de la
electrodinámica clásica que predice que una partícula cargada y acelerada, como
sería el caso de los electrones orbitando alrededor del núcleo, produciría
radiación electromagnética, perdiendo energía y finalmente cayendo sobre el
núcleo. Las leyes de Newton, junto con las ecuaciones de Maxwell del
electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo
del orden de s, toda la energía del
átomo se habría radiado, con la consiguiente caída de los electrones sobre el
núcleo. Se trata, por tanto de un modelo físicamente inestable, desde el punto de
vista de la física clasica
Nicolás Yair Malicoutakis
Suscribirse a:
Entradas (Atom)




