Modelo mecánico del átomo de Bohr
A continuación se presenta un montaje experimental que permite demostrar la aparición de ondas estacionarias circulares en un anillo de caucho que se hace vibrar. Considerando que el anillo representa la órbita seguida por el electrón alrededor del protón, y que el electrón puede visualizarse como una onda de materia, se encuentra que solo para ciertas frecuencias de vibración del sistema aparecen estados estacionarios. Estos corresponden, según la analogía establecida, a las órbitas estables planteadas por Bohr en su modelo.Materiales & Equipos
- Generador de señales
- Parlante
- Tabla de madera con anillo de cauchos
Descripción del experimento
El modelo del átomo de hidrógeno planteado por Niels Bohr en 1.913 consiste en un núcleo conformado por un protón sobre el que gira un electrón siguiendo una órbita circular. El electrón no se precipita hacia el núcleo por acción de la fuerza electrostática existente entre las cargas debido a que hay ciertas órbitas estables en las que puede permanecer el electrón.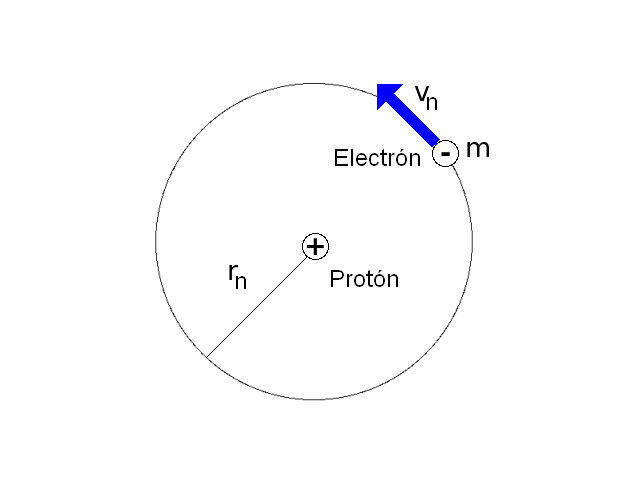
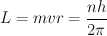
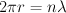
V.A
No hay comentarios:
Publicar un comentario